10月20日,國際學術期刊Nature Metabolism在線發表了中國科學院上海營養與健康研究所魯明研究組的合作研究成果,題為“Tumor-associated macrophages serve as an acetate reservoir to drive hepatocellular carcinoma metastasis”。該研究報道了腫瘤相關巨噬細胞(Tumor-associated macrophages, TAMs)與肝癌細胞之間“乳酸-脂質過氧化-乙酸”的全新代謝互作模式,揭示了TAMs作為微環境乙酸供應源,通過增加肝癌細胞乙酰輔酶A(acetyl-CoA)合成,促進肝癌轉移的作用機制,為肝癌轉移提供了潛在的微環境干預靶點。
乙酰輔酶A是細胞內關鍵的代謝中間物,它不僅是糖、脂質和氨基酸的分解代謝產物,也是脂質合成和三羧酸循環的起始代謝物,更重要的是,它還可作為蛋白質乙酰化修飾的底物影響基因表達的表觀調控。研究團隊的前期研究已發現酰基輔酶A硫酯酶12(ACOT12)依賴的乙酰輔酶A累積可通過表觀激活TWIST2基因的表達增強肝癌細胞的遷移能力。乙酰輔酶A累積促進癌細胞侵襲轉移的現象在其他多種癌癥中也得到證實,因此高水平乙酰輔酶A被認為是轉移性癌癥的關鍵代謝特征。已知癌細胞會大量攝取乙酸合成乙酰輔酶A以維持高乙酰輔酶A水平。然而,癌細胞所攝取乙酸的來源尚不清楚。已有研究表明,肝癌組織中乙酸水平,遠高于其在癌細胞主要的血液營養來源中的水平,提示癌周微環境內很可能存在生成乙酸的特異性細胞。
魯明研究組一直致力于脂質代謝物的細胞感知及其調控癌轉移的病理機制研究。為了尋找肝癌微環境中乙酸的來源,研究人員首先對肝癌微環境中不同的原代免疫細胞和基質細胞進行篩選,并利用體內清除實驗和體外誘導的TAMs進行分析驗證,鑒定出TAMs可特異性促進肝癌細胞乙酸水平的提高,并證實TAMs是通過分泌游離形式的乙酸到微環境中來實現這種特異性效應。進一步的機制研究發現,TAMs中脂質過氧化-乙醛脫氫酶2(ALDH2)途徑是調控其乙酸生成和分泌的關鍵代謝途徑。
那么TAMs來源的乙酸在肝癌轉移中發揮怎樣的作用呢?深入的研究發現,抑制TAMs中ALDH2或脂質過氧化途徑均顯著減弱了TAMs促肝癌細胞體外遷移的能力,而這種效應是通過抑制肝癌細胞乙酰輔酶A合成和組蛋白乙酰化實現。進一步利用髓系特異性敲除Aldh2小鼠構建肝癌原位移植瘤模型進行研究顯示,敲除TAMs的Aldh2可顯著減少原發瘤中肝癌細胞的乙酸水平,并抑制肝癌的肺轉移。以上體內外研究獲得的機制研究結果在人肝癌樣本中也得到了驗證,即人肝癌組織中ALDH2+?TAMs浸潤程度與臨近肝癌細胞組蛋白乙酰化水平呈正相關。最后,研究人員通過一系列篩選和驗證,鑒定出癌細胞來源的乳酸是TAMs脂質過氧化-ALDH2途徑激活的誘導因子。乳酸可通過提高活性氧(ROS)水平和上調Nrf2的表達激活TAMs的脂質過氧化-ALDH2途徑,從而形成肝癌細胞和TAMs之間“乳酸-脂質過氧化-乙酸”的互作環路。
該研究揭示了肝癌細胞與TAMs之間全新的代謝互作模式,為深入解析局部代謝微環境調控癌細胞表型轉化的機理提供了新思路。同時,研究還發現了脂質過氧化途徑可作為TAMs乙酸的主要來源,為靶向TAMs的脂質過氧化-ALDH2通路干預肝癌轉移提供了理論依據。
中國科學院上海營養與健康研究所博士研究生沈立、復旦大學附屬華山醫院王勝浩住院醫師和碩士畢業生高超為該論文的共同第一作者。中國科學院上海營養與健康研究所魯明研究員、復旦大學附屬華山醫院欽倫秀教授和朱文偉副主任醫師為論文的共同通訊作者。該研究工作得到了中國科學院上海營養與健康研究所周章森研究員、楊立峰研究員、胡國宏研究員、陳雁研究員、秦駿研究員,以及香港城市大學尹慧勇教授、復旦大學生物醫學研究院葉丹研究員和南方醫科大學/廣東省人民醫院高平教授的幫助和支持,也得到了中國科學院上海營養與健康研究所所級公共技術中心分析測試技術平臺和實驗動物技術平臺的支持。該研究工作還得到了國家重點研發計劃和國家自然科學基金等的資助。
文章鏈接:https://www.nature.com/articles/s42255-025-01393-9
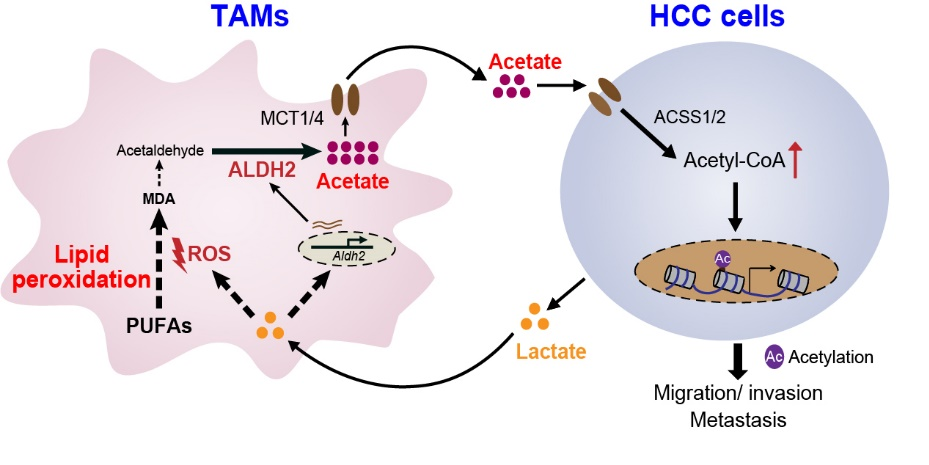
圖:TAMs與肝癌細胞間的“乳酸-脂質過氧化-乙酸”代謝互作模式
推送單元:魯明研究組、科技規劃與任務處