5月14日,中國科學院上海營養與健康研究所錢友存研究組,聯合中國科學院分子細胞科學卓越創新中心宋昕陽研究組,在Nature雜志在線發表了題為“Targeting symbionts by apolipoprotein L proteins modulates gut immunity”的研究成果。該研究首次揭示了小鼠腸道上皮細胞(Intestinal epithelial cells, IECs)分泌的載脂蛋白APOL9a/b及其人源同源蛋白APOL2可特異性識別擬桿菌目(Bacteroidales)細菌,誘導其釋放外膜囊泡(Outer membrane vesicles, OMVs),并激活宿主免疫因子IFN-γ-MHC-II信號通路,從而提升腸道黏膜屏障的抗感染能力。這項研究揭示了宿主免疫系統通過精細機制調控腸道微生態平衡,拓展了對宿主與共生菌共同進化互作機制的理解,為菌群相關疾病的精準干預與治療策略創新奠定了理論基礎。
哺乳動物腸道是宿主與共生微生物互作的核心界面。腸道微生物來源的代謝產物(如膽汁酸、短鏈/長鏈脂肪酸)及膜結構分子(如多糖A、α-半乳糖神經酰胺)等生物活性小分子可跨越腸道上皮屏障,進而調控宿主免疫細胞分化與功能。例如,誘導結腸調節性T細胞(Regulatory T cells, Tregs)分化或促進小腸上皮內淋巴細胞(Intraepithelial lymphocytes, IELs)的聚集。與此同時,宿主則通過上皮黏液屏障、抗菌蛋白(Anti-microbial peptides, AMPs)、分泌型免疫球蛋白(Secretory immunoglobulin A, sIgA)及補體成分(如Complement 3,C3)等防御機制維持菌群穩態。然而,現有研究主要聚焦于廣譜性、非特異性的防御策略,對于宿主是否具備選擇性識別并調控特定共生菌群成員的能力仍缺乏深入理解。
為了系統挖掘宿主調控腸道菌群的關鍵分子,研究人員首先借助高通量蛋白質組學技術,對常規飼養(Conventional raised, CR)小鼠和無菌(Germ-free, GF)小鼠回腸黏液層中的蛋白質組成進行了全面對比分析。通過篩選菌群依賴性表達上調的蛋白質,并利用CR小鼠中回腸共生菌群結合蛋白的蛋白質組進行聯合分析,研究人員最終聚焦于一類此前功能未明的脂蛋白家族成員——Apolipoprotein L9a/b(APOL9a/b, 或APOL9),并確認其表達受菌群調控。同時,單細胞測序及免疫熒光分析顯示APOL9a/b主要來源于腸上皮吸收細胞(Enterocyte)。為探明其靶向的共生菌是否具有微生物系統發育特異性,團隊進一步結合流式細胞分選技術與16S rRNA基因測序技術,創建了“APOL9-seq”策略,并對APOL9蛋白結合的腸道微生物進行了全面分析。研究結果顯示,無論是在小鼠還是在人源微生物結合實驗體系中,APOL9a/b及其人類同源物APOL2都表現出極強的群體選擇性,幾乎專一性地識別并結合擬桿菌目(Bacteroidales)細菌。
那么,APOL9/APOL2是如何實現對擬桿菌目細菌“精準鎖定”的呢?研究人員猜測擬桿菌目細菌特有的細胞膜鞘脂組分可能介導該識別過程。隨后,研究人員通過選取擬桿菌屬的代表共生菌——多形擬桿菌(B.thetaiotaomicron)作為模式菌株,并利用基因編輯技術成功敲除其多個鞘脂生物合成相關基因。實驗發現,APOL9/2蛋白對B. thetaiotaomicron的結合能力依賴于其細胞膜上的一類特殊脂質——神經酰胺-1-磷酸(Ceramide-1-phosphates, Cer1Ps)。一旦敲除Cer1P合成關鍵酶,APOL9/2與擬桿菌的結合能力明顯下降,表明Cer1P是介導其識別的關鍵分子。這一結果首次揭示,宿主可通過識別共生菌特有脂質結構,從而精準“靶向”特定微生物群落。
有別于傳統抗菌肽直接殺菌的方式,APOL9在生理濃度下與擬桿菌結合后并不引發細胞死亡,而是以一種非致死性的方式誘導這些革蘭氏陰性菌釋放大量外膜囊泡OMVs。這些OMVs直徑在幾十至數百納米之間,富含細菌來源的脂類、蛋白和多糖等成分,因而可被宿主先天免疫系統識別并激活相應通路。功能實驗進一步表明,這些由APOL9誘導產生的OMVs不僅能被宿主樹突狀細胞(Dendritic cell,?DC)捕獲,還能有效增強黏膜區域的IEC-T細胞互作介導的免疫反應。具體而言,它們通過激活干擾素-γ(IFN-γ)信號通路,顯著提升小腸上皮細胞中MHC II類分子的表達水平,從而促進腸道上皮間一類具有重要免疫調節功能的CD4?CD8αα? ?IEL的發育和維持。在體內功能驗證層面,研究團隊構建了Apol9a/b雙敲除小鼠模型,并發現其小腸上皮的MHC-II分子及CD4?CD8αα? IEL水平均發生下調,且這一調控現象依賴于小鼠腸道擬桿菌的存在。同時,在沙門氏菌(Salmonella typhimurium)經口感染實驗中,研究人員也發現APOL9缺失小鼠不僅腸道局部病原負載顯著升高,而且細菌易擴散至肝臟、脾臟等內臟器官,表現出更高的系統性感染風險和死亡率。相反,當給予這些小鼠擬桿菌來源的OMVs時,宿主的各項腸道免疫防御指標也顯著提升,因而其感染癥狀也得到明顯緩解。
這項研究不僅首次揭示了一類宿主新型載脂蛋白如何通過特異性識別共生菌膜脂分子并誘導其釋放具有免疫調節活性OMVs的因果機理,還為我們理解宿主如何“主動塑造”腸道微生態提供了新的理論框架,同時也為開發下一代基于菌群精準調控的免疫干預手段奠定了分子基礎。
中國科學院上海營養與健康研究所副研究員楊濤、博士研究生胡孝虎,與中國科學院分子細胞科學卓越創新中心博士研究生曹飛為論文的共同第一作者。中國科學院上海營養與健康研究所錢友存研究員和中國科學院分子細胞科學卓越創新中心宋昕陽研究員為文章共同通訊作者。該工作得到哈佛大學醫學院Dennis L. Kasper教授、清華大學醫學院梁冠翔教授、中國科學院分子細胞科學卓越創新中心石建濤研究員、中國科學院上海營養與健康研究所胡國宏研究員的支持和幫助。該工作得到了科技部國家重點研發計劃項目、國家自然科學基金委、中國科學院B類先導專項、中國科學院“未來伙伴網絡專項”及上海市科委項目的資助。 該工作同時獲得中國科學院上海營養與健康研究所所級公共技術中心,中國科學院分子細胞科學卓越創新中心生信平臺、化學生物學平臺,中國科學院腦科學與智能技術卓越創新中心電鏡平臺,中國科學院上海免疫與感染研究所動物平臺,上海交通大學流式平臺,中科脂典公司及諾米代謝公司等多家單位、企業的技術支持。
論文鏈接:?https://doi.org/10.1038/s41586-025-08990-4
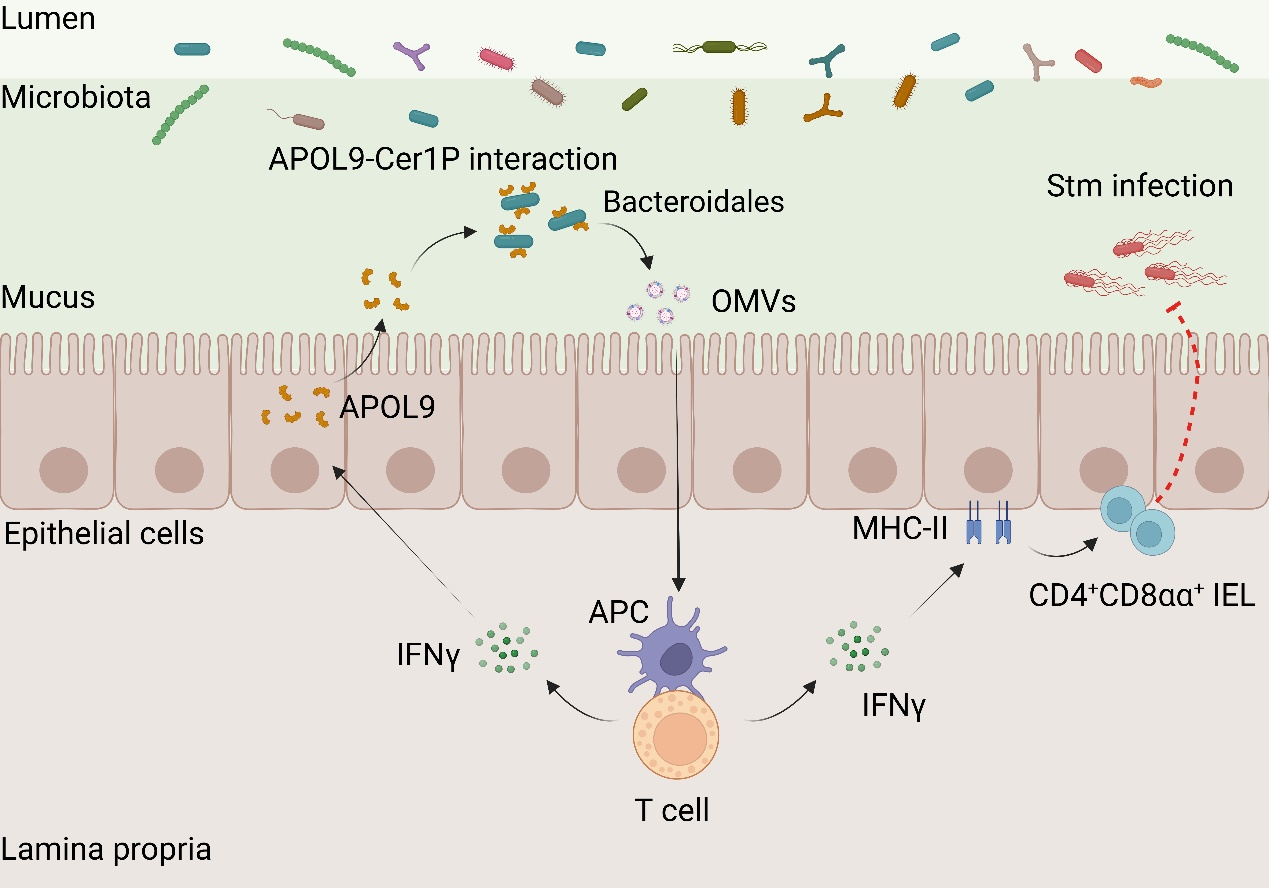
圖:新型載脂蛋白APOL9通過結合擬桿菌Cer1P分子誘導OMVs釋放并激活IFN-γ-MHC-II通路以增強腸道黏膜免疫